جيمس ويب يرصد دفقة كربونية مدهشة حول نجم صغير
28 June 2024
نشرت بتاريخ 7 يونيو 2024
خوارزمية تفحص صور الخلايا النقيلية بغية تحديد موقع الورم الأساسي.
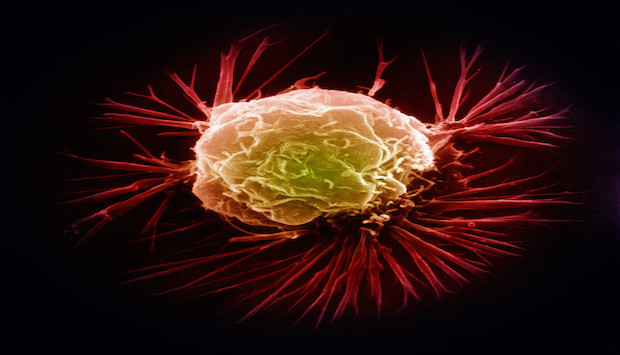
بعض السرطانات المستترة تظل غير مكتشفة إلى أن تنتقل من مكمنها ومكان نشأتها إلى أعضاء بعيدة في الجسم. مما دفع العلماء إلى تطوير أداة ذكاء اصطناعي (AI) بغية الوصول إلى منشأ الخلايا السرطانية النقيلية التي تنتشر في الجسم1، فإذ بهذه الأداة تتفوق على أخصائيي الأمراض في أداء هذه المهمة. قد يعين هذا النموذج التجريبي الأطباء في تحسين سبل تشخيص السرطان في مراحله المتأخرة وعلاجه، وإطالة أعمار الأشخاص.
"يعد هذا الاكتشاف غاية في الأهمية، حتى إنه يمكن الاعتماد عليه كوسيلة مساعدة"، على حد قول فيصل محمود، الذي يدرس تطبيقات الذكاء الاصطناعي في حقل الرعاية الصحية بكلية طب هارفارد في بوسطن بماساتشوستس.
لا بد أن يعرف الأطباء من أين جاءت السرطانات النقيلية، كيما يتسنى لهم علاجها. ويتعذر الوقوف على منشأ ما يصل إلى 5% من الأورام كافة، وفي حال المرضى الذين يظل السرطان الأساسي لديهم غير معروف، تكون توقعات سير المرض ضعيفة ومحدودة.
وثمة طريقة مستخدمة لتشخيص السرطانات النقيلية المراوغة تعتمد على العثور على الخلايا السرطانية في السوائل المُستخرجة من الجسم. حيث يفحص الأطباء الإكلينيكيون صور الخلايا السرطانية ويضاهونها بأنواع الخلايا السرطانية المختلفة للتحقق من النوع الذي تشبهه. فعلى سبيل المثال، خلايا سرطان الثدي التي تنتقل إلى الرئتين يظل لها شكل خلايا سرطان الثدي الذي يميزها.
يفد كل عام 300 ألف شخص جديد من مصابي السرطان إلى المستشفى التابع لجامعة تيانجين الطبية في الصين لتلقي العلاج، يجرى تشخيص زهاء 4 آلاف شخص من هؤلاء بالاستناد إلى طريقة تفقد الصور، ويظل نحو 300 شخص بلا تشخيص معروف، كما يشير تيان في، جراح سرطان القولون والمستقيم بالجامعة.
من هنا أراد تيان، ولي سيانجشون، الباحث في مجال المعلوماتية الحيوية المتخصص في دراسة التعلم العميق بالجامعة، وزملاؤهما تطوير خوارزمية تعلم عميق لتحليل هذه الصور والتنبؤ بمنشأ السرطانات. ونُشرت النتائج التي توصلوا إليها في دورية «نيتشر ميديسن» Nature Medicine في السادس عشر من أبريل الماضي.
درب الباحثون نموذج الذكاء الاصطناعي الذي طوره على نحو 30 ألف صورة للخلايا السرطانية التي عُثر عليها في السوائل المستخرجة من منطقة البطن أو الرئتين من 21 ألف شخص لم يكن معروفًا الورم الأصلي لديهم. ثم اختبروا نموذجهم على 27 ألف صورة، فوجدوا أن احتمال أن يتنبأ النموذج بدقة بمصدر الورم بلغ 83%. كما كان احتمال أن يكون مصدر الورم من ضمن التوقعات الثلاثة الأولى للنموذج يصل إلى 99%.
وتوفر قائمة بالتوقعات الثلاثة الأهم لهو أمر نافع فهو الذي من شأنه أن يساعد الإكلينيكيين في تقليص عدد الاختبارات الزائدة - والتي غالبًا ما تكون باضعة - الضرورية لتحديد منشا الورم، كما يقول محمود. والتوقعات محصورة عادة في 12 مصدر شائع للسرطان، منها سرطانات الرئة والمبايض والثدي والمعدة. أما بعض أشكال السرطانات الأخرى، كتلك التي تنشأ في البروتستاتا والكلى، فلا يمكن التعرف عليها، حيث إنها لا تنتقل عادة إلى الرواسب السائلة في منطقة البطن والرئتين، بحسب لي.
وعند اختبار النموذج على نحو 500 صورة، كان أداءه في التنبؤ بمنشأ الورم أفضل من أداء أخصائيي الأمراض. وكان هذا الفارق في الأداء له دلالة إحصائية.
قيم الباحثون أيضًا بأثر رجعي مجموعة فرعية من المشاركين في الدراسة قوامها 391 مشارك، مضى نحو 4 سنوات على تلقيهم علاج السرطان. ووجدوا أن هؤلاء الذين تلقوا علاج لنوع السرطان الذي تنبا به النموذج كان يزيد احتمال نجاتهم من السرطان وعيشهم لفترة أطول قياسًا إلى المشاركين الذين لم تتطابق توقعات النموذج والسرطان الأصلي لديهم. "وهذه حجة غاية في الإقناع" على أهمية استخدام الذكاء الاصطناعي في التجارب الإكلينيكية، بحسب محمود.
وكان محمود قد لجأ من قبل إلى الذكاء الاصطناعي للتنبؤ بمنشأ السرطان بالاستعانة بعينات مأخوذة من الأنسجة2، فيما استعانت فرق أخرى بالبيانات الوراثية. ويقول إن جمع مصادر البيانات الثلاثة معًا - الخلايا والأنسجة والعوامل الوراثية - من شانه أن يحسن نتائج علاج المرضى الذين يعانون من الانتشار النقيلي للسرطان من مصدر مجهول.
نُشر في دورية Nature بتاريخ 17 إبريل.
doi:10.1038/nmiddleeast.2024.174
تواصل معنا: